Inhaltsverzeichnis
1 Allgemeines
2 Geschichte
3 Vorkommen
4 Gewinnung und Verwendung
5 Reaktivität und Verbindungen
6 Sonstiges
7 Siehe auch
Allgemeines
Silizium (fachsprachlich Silicium geschrieben) steht in der 4. Hauptgruppe (Tetrele) des Periodensystems der Elemente und zählt zu den Halbmetallen. Reines, elementares Silizium besitzt eine grau-schwarze Farbe und weist einen typischen metallischen Glanz auf.
Es ist im Handel sowohl als feinkörniges Pulver als auch in grösseren Stücken erhältlich. Hochreines Silizium für Solarpanels oder Halbleiter weist einen typischen metallischen, bronzenen bis bläulichen Glanz auf.
Elementares Silizium ist für den menschlichen Körper ungiftig, in gebundener silikatischer Form ist Silizium für den Menschen essentiell. Siliziummangel führt unter anderem zu Wachstumsstörungen des Knochengerüstes. Der menschliche Körper enthält etwa 20 mg/kg Körpergewicht Silizium, der Wert nimmt im Alter jedoch ab.
Geschichte
In Jahr 1811 stellten der Chemiker Joseph Louis Gay Lussac und der französische Adlige Baron Louis-Jacques Thénard (vgl. Thenards Blau) vermutlich erstmals unreines und amorphes Silizium durch Umsetzung von Siliziumtetrafluorid mit elementarem Kalium her. Ein ähnliches Vorgehen wurde 1824 von Jöns Jakob Berzelius in Schweden durch Umsetzung eines Hexafluorosilikates mit elementarem Kalium beschritten. Berzelius reinigte das so erhaltene amorphe Silizium durch Waschen auf, erkannte als erster die elementare Natur des Siliziums und gab ihm auch seinen Namen. Der Begriff Silizium leitet sich vom lateinischen Wort silex (Kieselstein, Feuerstein) ab. Er bringt zum Ausdruck, dass Silizium häufiger Bestandteil vieler Minerale ist. In der Tat ist Silizium mit einem Anteil von etwa 26 Gewichtsprozent nach Sauerstoff und noch vor Aluminium das zweithäufigste Element der Erdkruste.
Der englische Begriff silicon wurde 1831 von dem Engländer Thomas Thompson vorgeschlagen. Die Endung -on soll dabei auf die chemische Verwandtschaft zum Kohlenstoff (carbon) hinweisen. Die erstmalige Herstellung reinen, kristallinen Siliziums gelang im Jahre 1854 dem französischem Chemiker Etienne Henri Sainte-Claire Deville mittels Elektrolyse.
Vorkommen
Silizium tritt in der Natur ausschliesslich als Oxid auf, und zwar entweder in Form von Siliziumdioxid oder in Form silikatischer Mineralien.
Wesentliches Bauelement aller Silizium-Sauerstoff-Verbindungen sind dabei immer SiO
4-Tetraeder. Durch Polykondensation solcher SiO
4-Tetraeder, die über gemeinsame Ecken, Kanten oder Flächen verknüpft werden, können komplexe Ketten, Ringe, Schichten und andere Vernetzungsmuster ausgebildet werden.
So bestehen Sand und Quarz vorwiegend aus Siliziumdioxid. Viele Halbedelsteine bestehen im wesentlichen aus Siliziumdioxid, etwa der Bergkristall, Amethyst, Rosen- und Rauchquarz, Achat, Jaspis und Opal. Beispiele für silikathaltige Mineralien sind Ton, Schiefer, Feldspat und Sandstein.
Neben der bereits erwähnten essentiellen Natur des Siliziums, gibt es eine Reihe von Lebewesen, die siliziumdioxidhaltige Strukturen erzeugen. In der Fauna nutzen dies beispielsweise die Kieselalgen (Diatomeen), welche sich durch Kondensation von Monokieselsäure Si(OH)
4 ein Exoskelett aus Siliziumdioxid aufbauen. Aus der Pflanzenwelt sei der Schachtelhalm erwähnt, welcher in seinen Blättern durch ein Siliziumdioxidgerüst zusätzliche Stabilität erhält. Siehe auch Kieselsäure.
Gewinnung und Verwendung
Elementares Silizium findet in unterschiedlichen Reinheitsgraden Verwendung in der Metallurgie (Ferrosilizium), der Photovoltaik (Solarzellen) und in der Mikroelektronik (Halbleiter, Computerchips). Demgemäss ist es in der Wirtschaft gebräulich, elementares Silizium anhand unterschiedlicher Reinheitsgrade zu klassifizieren. Man unterscheidet Si
mg (
metallurgical grade, Rohsilizium, 98-99 % Reinheit), Si
sg (
solar grade, Solarsilizium, 99.99 % Reinheit) und Si
eg (
electronic grade, Halbleitersilizium, Verunreinigungen < 1 ppb).
Im industriellen Massstab ist elementares Silizium durch Reduktion von Siliziumdioxid mit Kohlenstoff im Lichtbogenofen bei Temperaturen von etwa 2000 °C erhältlich.
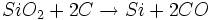
Von diesem industriellen Rohsilizium (Si
mg) wurden im Jahr 2002 etwa 4,1 Millionen Tonnen hergestellt. Es ist für metallurgische Zwecke ausreichend sauber und findet Verwendung als Legierungsbestandteil für Weissblech und Stähle (Verbesserung der Korrosionsbeständigkeit) sowie als Ausgangsstoff für die Silanherstellung über das Rochow-Verfahren, welche schliesslich im Wesentlichen zur Herstellung von Silikonen dienen. Zur Herstellung von Ferrosilizium für die Stahlindustrie (Desoxidationsmittel im Hochofenprozess) wird zweckmässigerweise obige Reaktion unter Anwesenheit von elementarem Eisen durchgeführt.

Für photovoltaische Anwendungen muss das Rohsilizium jedoch weiter zum Solarsilizium (Si
sg) gereinigt werden. Dazu wird es im Siemens-Verfahren zunächst mit gasförmigen Chlorwasserstoff bei 1100 °C in einem Wirbelschichtreaktor zu Trichlorsilan (Silicochloroform) umgesetzt.


Bergkristall aus SiO2 |
Nach aufwändigen Destillationsschritten wird das Silicochloroform in Anwesenheit von Wasserstoff in einer Umkehrung der obigen Reaktion an beheizten Reinstsiliziumstäben wieder thermisch zersetzt. Das elementare Silizium wächst dabei auf die Stäbe auf. Der dabei freiwerdende Chlorwasserstoff wird in den Kreislauf zurückgeführt. Als Nebenprodukte fällt Siliciumtetrachlorid an, welches entweder zu Trichlorsilan umgesetzt und in den Prozess zurückgeführt, oder in der Sauerstoffflamme zu pyrogener Kieselsäure verbrannt wird.
|
Eine chlorfreie Alternative zu obigem Verfahren stellt die Zersetzung von Monosilan dar, welches ebenfalls aus den Elementen gewonnen werden kann und nach einem Reinigungsschritt an beheizten Oberflächen oder beim Durchleiten durch Wirbelschichtreaktoren wieder zerfällt.
|


